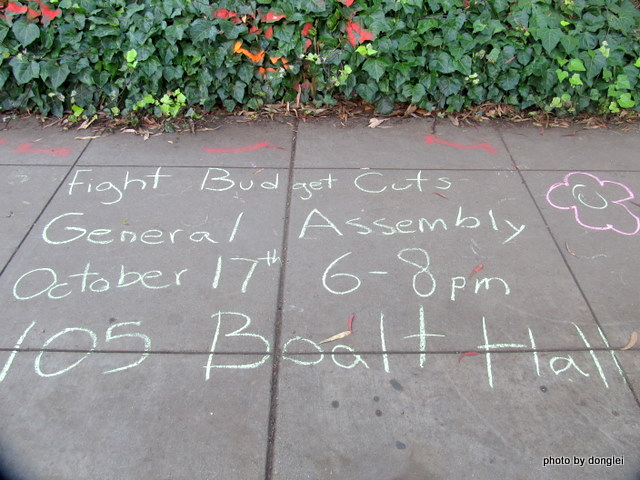走出狭小空间,才能看到如画的风景
好了,我终于可以告诉你,上个月11日-21日,我首次美国之行的主要任务是什么。
没错,又是赵戬,又是核酸,又是诺华诊断。
感谢您,赵戬博士,是您促成包括《健康报》、《中国医药报》和《医药经济报》在内的国内三家专业健康媒体此次旧金山湾区艾莫利维尔生命科学园区诺华诊断总部之行。
必须承认,在我的身边,有不少比我年长一些的朋友,他们就职于各大制药公司研发部门,因采访而与其结识,赵戬博士就是之一。虽然交往不多,但总能得到智慧和启迪,读他们的故事,听他们的话语,琢磨他们的人生滋味时,却又觉得内心很近。
凑巧的是,《医药经理人》杂志也是在同一时间,由社长谭勇带队,在美中药协(SAPA)的穿针引线下,首次赴美考察。他们连同国内本土公司一起,共同探讨如何合作开发新的欧美市场。在美期间,他们参观了默沙东新泽西的研发中心、诺华波士顿的研发大楼、健赞等公司总部。
回来之后,我与谭勇有一次通话。他谈到几点:一,西方制药业的底气之足,完全看不出任何没落的迹象,各种保障措施非常到位;二,尽管国内制药企业这些年跨越式的发展并不像跨国药业所认为的那样不思长进,但是,当将所谓国内制药界老大级公司放到和全球跨国公司一个平台上看,显然不堪一击。
我问他具体看到了什么,他说,在默沙东的研发中心看到了一台台的机器,几乎没有人。“这些机器是在做什么的呢?化合物筛选么?”我问,当时距离东部3个小时时差的我十分好奇。
不知道啊,谭勇叹息说,也是此次赴美考察的一大遗憾——语言不通。“来到人家的实验室,不知道该说什么,从哪里说起。”他说,下次出门前真的要好好练一下。他强调是“练”英文,而不是“学习”。
尽管如有盲人摸象,在默沙东,谭勇听到了一个让他印象深刻的观点,后来写进了当期杂志——默沙东的科学家对化学药和生物药的比较是,随着时代认知水平的提高,化学药的优势会进入新的领地,而那时,热门的生物药其安全风险或将大面积暴发出来。
对我来说,这次的美国之行,是人生的第一次,开阔了视野,亲历了西方社会的生活和文化,内心受到震撼。最难得的是,通过这次采访,我和我哥在北美得以相聚,他带着我走了不少地方,见到了亲人,而采访本身也变得不重要了。
走出狭小空间,才能看到如画的风景
——旧金山湾区艾莫利维尔生命科学园区诺华诊断总部纪行
时间:2011年10月11-14日
旧金山湾区是美国加利福尼亚州北部的一个大都会,《财富》杂志公布的美国500强企业,总部设在旧金山湾区的就有28个。曾几何时,位于湾区的硅谷成为了美国电子行业创新、研发的代名词。
山景城 (Mountain View)微软的总部。
在湾区半岛的东岸,有一座人口不到8万的小城市——艾莫利维尔(Emeryville)市。比起她相邻的伯克利和奥克兰,艾莫利维尔显得有点名不见经传。
但提起史蒂夫·乔布斯的动画工作室皮克斯公司,相信为不少“果粉”所熟悉。
我们的采访就从距离皮克斯不到两个路口的另一家同样具有创新传统的研发大楼开始。
独特的建筑理念
围绕着宽大走廊的内侧,镶嵌着一个个小小的“格子”,这是每位科学家的办公室。办公室很小且没有窗户,外围一圈则是他们的实验室。
实验室宽大明亮,朝外一侧全部是落地大玻璃窗,透过窗户可以看到湾区独特秀丽的风景——不远处是生物技术巨头基因泰克的办公区。这是诺华诊断公司位于艾莫利维尔市总部的研发大楼。
“科学家只有从狭小的独立办公室走出来交流,才能看到外面的世界。”面对来自中国医药行业的专业媒体,诺华诊断美国负责人伊森·诺顿先生讲述了他们的建筑设计理念,该理念反映了诺华管理层对研发人员的要求:研发团队之间只有通过不断地交流,脚踏实地地做研究,才能有创新的成果。
此栋大楼里曾发明过PCR检测方法。
就在这栋大楼旁边,另一栋具有历史意义的楼房正待拆迁。1984年,诺华诊断的前身——凯荣公司(Chiron)在这栋旧实验大楼发明了PCR检测的方法。1981年创立于艾莫利维尔的凯荣,是一家专注于生物药、疫苗和血液筛查的研发型公司,它的名称源于希腊神话中的半人马怪兽(Centaur)。
1991年,凯荣收购了Cetus公司,后者是美国首批生物技术研究型公司,1971年成立于伯克利,但大部分业务在艾莫利维尔。
提及伯克利,这里用一张图片插播一个小片段。一天早餐也没吃,跟着大部队坐着出租车来到著名的伯克利大学。在那栋标志性的建筑下,看到学生在地上用粉笔写下的字样,拍了下来。
回国一个月后,得知伯克利大学的学生正在游行。电影《阿甘正传》里面学生运动的领袖就来自伯克利,当时那辆车上还有”Berkeley to Washington DC”字样。
凯荣有一个宏伟的生命科学园区计划,1995年,市议会批准在霍利斯(Hollis)街、第45街、斯坦福大道和铁路之间进行统筹区域开发。这项整体规划包括在30年期间建设7幢实验大楼、3幢高层写字楼和支持设施在内的14幢新建筑。
透过Biocine公司,凯荣与瑞士制药业巨头汽巴嘉基公司(诺华的前身)结成伙伴关系,利用基因工程技术研发疫苗和治疗、预防、诊断诸如艾滋病、疱疹和疟疾之类的疾病。
2006年,凯荣被瑞士跨国制药公司诺华收购,随后诺华有了今日的疫苗及诊断业务部。分拆出的Cetus公司业务被拜耳以21亿美元收购。今天,诺华和拜耳共同在艾莫利维尔生命科学园区办公,各自使用不同的厂房设施。
团队合作
在诺华诊断,良好的协作氛围扩大了团队人员之间的接触机会,促进思想交流,增强了解决问题的能力。诺华诊断全球副总裁埃瑞克·怀特说:“在一个团队里,每一人有不同的想法和创意,我喜欢这样多元化,而不是每个人都在想同样的事。作为一个组织的领导人,我们把这些多元化的人综合在一起,给他们一个讨论的平台。我会给他们设立目标,让他们负责,让他们做决定,因为他们最接近每一个项目,整个团队都特别热爱自己的项目。”
“尽自己所能,令这个世界变得更美好。”
诺华诊断临床及科研事务部全球业务负责人丽莎·丹泽博士就是项目负责人之一,她在诺华已有15年的工作经验,曾参与主持过诺华与浙江天元生物药业的疫苗合资项目,现在负责艾莫利维尔园区诺华诊断的临床开发业务。丹泽告诉记者,在全世界范围内,杜绝输血传染病的传播是安全输血的一个重要环节。为避免经血液传播肝病、艾滋病而对献血员进行乙肝、丙肝和艾滋病病毒抗原抗体筛查。长年从事医学研究的丹泽博士,对于自己的工作非常热爱。“尽自己所能,令这个世界变得更美好。”丹泽说。
培训主管介绍诺华诊断核算检测仪器。
目前诺华诊断与Gen-Probe公司合作开发的NAT血液筛查系统,比其它任何血液筛查系统可多筛查出92万个单位。38个国家的血库正在使用诺华Procleix系统,美国供应的80%多的血液用该系统测试。而据诺华诊断亚太区政府事务总监赵戬博士介绍,随着我国核酸监测试点工作正式进入实施阶段,国内核酸血筛领域发展前景广阔。
以少胜多
在全球,受经济危机影响,各大公司都缩减研发开支,甚至关闭研发中心,诺华诊断却非常“幸运”,在血液安全领域处于全球领先,并不断加大投入。从1984年的HIV-1基因组的测序和1987年发现丙型肝炎基因组开始,诺华诊断不断研发筛查、预防血液传播疾病的先进解决方案。据怀特介绍,最近3~5年,诺华诊断的研发投入翻了一番,但接下来的投入还能否增加,要看销售业绩,特别是亚太市场的增长,尤为重要。
午餐的时候,公司所有华人员工全部出动。这里有大陆过去的,来自上海,天津,佛山,有台湾人,香港人,最早是84年移民,还有不到5年的新移民。
“我们在支出的时候要有智慧。”怀特强调。
除了加强内部研发人员的管理和交流,寻求外部合作也是诺华诊断重要的研发策略。怀特认为,研发新技术必须通过建立合作关系来实现,而选择正确的合作伙伴非常重要。在谈及诺华诊断选择合作伙伴的标准时,怀特说:“我曾经看过一部电影,讲述的是棒球队星探选拔球员的故事。影片中介绍了美国一些知名棒球队选择球员时付了很多钱,但球员表现并不是很好。而一些小球队由于没有办法与财大气粗的球队竞争,所以,他们把有限的钱投入到少量有能力的球员身上。同样取得了成功。”怀特说,这个故事放在诺华诊断同样适用——不是投入10亿、20亿收购成熟公司,而是选择有潜力的小公司。“至于谁拥有这个潜力,需要向行业领袖了解。为此,诺华诊断一直在不同领域寻求收购。”
为了配合此次采访,我们还来到太平洋血液中心。在美国,一个很流行的献血口号是“给你一个礼物,生命”,在美国人的心目中,献血是崇高的行动,是给同胞一个新的生命。是其他任何礼物都无法比拟的。
在血站,我跟一个有四分之一中国血统的献血者交流。碰巧她也是一个记者,不用坐班,可以经常来献血。我问她躺在这里什么感觉,她说就像在家一样。据统计,美国每年参加献血的人数约占8%,献血人数占一国人口总数的4%,即能满足全国临床用血的需要。无偿献血已经成为衡量一个国家社会文明程度的标志。
采访结束的最后一天,我一个人坐在公司外面的长椅上等车,听着远处一群黑孩儿叽叽喳喳。一个白种女人遛狗,不停地跟她的宝贝说话,居然让我想起了月月。面前是一个recycle的垃圾桶。
墙里秋千墙外道。墙外行人,墙里佳人笑。笑渐不闻声渐悄,多情却被无情恼。
分别的时候,我哥说,时光流逝,再来看我。